导语:
顽固的生物膜感染由于其具有持久性、反复发作和耐药性大幅增强等特点对人类健康和医疗发展构成了重大威胁。光动力疗法在治疗生物膜感染性疾病方面展现出广泛的应用潜力。然而,如何应对生物膜具有的药物渗透率低与缺氧微环境等难点,并通过靶向细菌信号传导系统和外排泵预防反复感染和克服生物膜耐药性仍然是一项艰巨的挑战。到目前为止,尚未设计有效的光敏剂(PS)以解决上述难题,更无法有效地抑制生物膜的反复发作和克服生物膜耐药性。近日,西南交通大学吴明雨与封顺教授课题组在该研究领域取得了新进展。(Advanced Materials. 2023 2309797. DOI: 10.1002/adma.202309797.)。
文章链接:https://doi.org/10.1002/adma.202309797
前沿科研成果:硼酸功能化的阳离子I型光敏剂
带正电荷的抗菌药物可以与细菌质膜和生物膜胞外基质(EPS)的负电荷通过静电作用结合,有效增强了对生物膜的渗透性。此外,I型PS对氧浓度的依赖性较小,且产生的羟基自由基是生物学上最致命的反应性活性氧(ROS)之一,在对抗生物膜上具有天然的优势。然而,很少有抗菌剂能够完全根除生物膜及其中的细菌。残留细菌利用信号转导系统[如双组分系统(TCS)和群体感应(QS)]使生物膜重新生长,并调节外排泵增强其耐药性,产生持久性细菌和再生生物膜导致生物膜疾病反复发作。多糖及糖基化蛋白,不仅作为信号传导系统和多药外排系统的重要组成成分,而且在细菌的定植、免疫逃避和生物膜的形成(包括黏附、入侵和毒力)等过程中发挥着重要作用,是临床重要的生物标志物,为针对信号转导及多药外排提供了潜在的靶标。
该团队致力于光敏抗菌药物的开发,在前期工作中,提出了质膜靶向策略和多模式联合治疗策略解决细菌耐药性。针对传统阳离子抗菌药物潜在的毒性和提高光敏药物在复杂场景中的临床应用潜力。通过对PS电荷调控实现对革兰氏阳性菌(G+)、革兰氏阴性菌(G-)和肿瘤细胞选择性结合和分级分类治疗(ACS Appl. Mater. Interfaces, 2023, 15, 17433−17443; Chem. Eng. J. 2023, 454, 140189. );利用噬菌体对细菌的高度选择性,将光敏剂通过共价键修饰在噬菌体得到功能化噬菌体,实现对临床败血症样品60min的精准快速检测,光动力和噬菌体鸡尾酒疗法协同治疗(Adv. Mater., 2023, 35, 2208578);利用磁性纳米材料的磁捕获特性提高光敏剂在败血症早期对低浓度的细菌结合性能,缓解炎症风暴的发生,并充分利用磁分离特性解决抗菌药物或纳米材料通过血液循环导致的潜在毒性 (Adv. Funct. Mater., 2023, DOI:10.1002/adfm.202312162);通过光敏剂与质膜的强结合性能,有效提高其质膜结合性能和生物膜渗透性,且与生物膜形成和耐多药外排相关的多种蛋白质结合,避免耐药性的产生(Adv. Sci., 2023, DOI:10.1002/advs.202207736)。
在此基础上,该团队在质膜靶向抗菌的理念指导下,通过调节正电荷数目和多糖靶向的硼酸基团提高质膜结合能力和EPS渗透性,设计合成系列I型PS(ACR-DM、ACR-DME、ACR-DMB和ACR-DMP)。合适的D-A体系可以减少激发的三重态和基态之间的能隙,阻止与氧气的能量交换过程,从而通过电子转移促进I型ROS的产生,有效克服生物膜缺氧微环境。其中ACR-DMP修饰了硼酸基团,可与细胞壁、EPS 和质膜糖蛋白中丰富的多糖中存在的顺二醇基团高效结合,不仅可以增强生物膜的结合和清除活性,还抑制信号转导系统和外排泵,有效避免耐药性的产生,抑制生物被膜的复发。(图1)
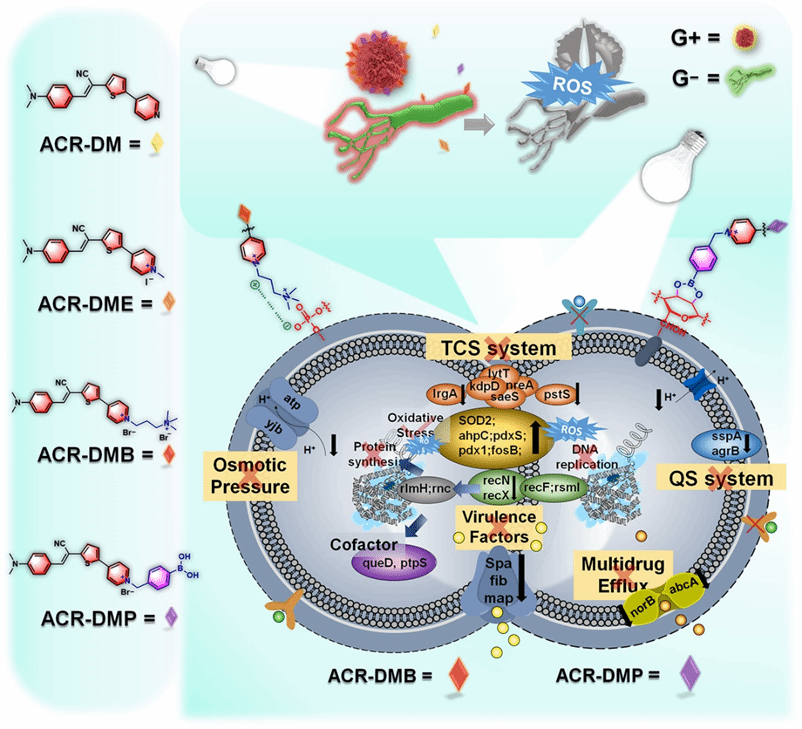
图 1. 光敏剂分子结构,并通过多重机制克服细菌多重耐药性
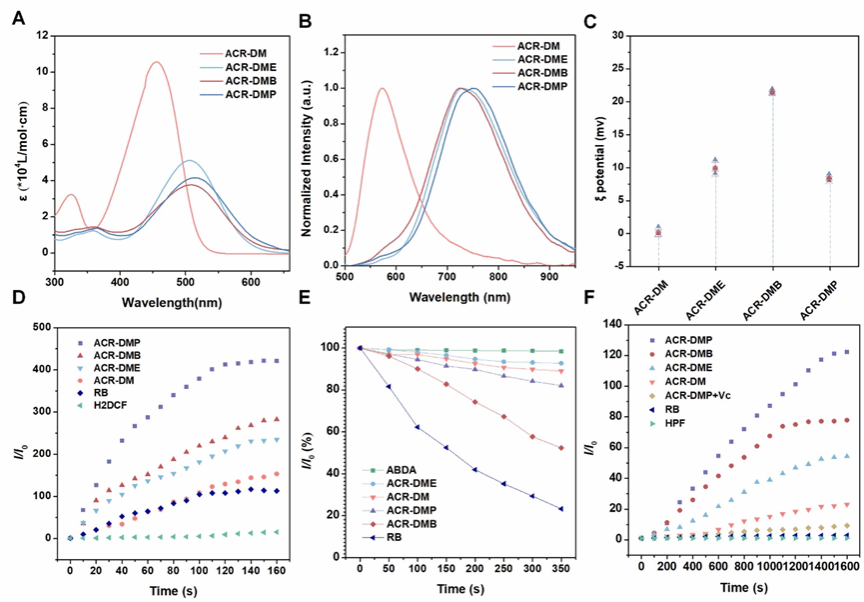
图2.光敏剂的光物理特性
PSs的光物理性质如图2所示。其中ACR-DMB可通过I型和II型通路产生ROS,而ACR-DM、ACR-DME和ACR-DMP作为纯I型PSs,高效生成•OH。ACR-DMP表现出最高的ROS和•OH生成效率。
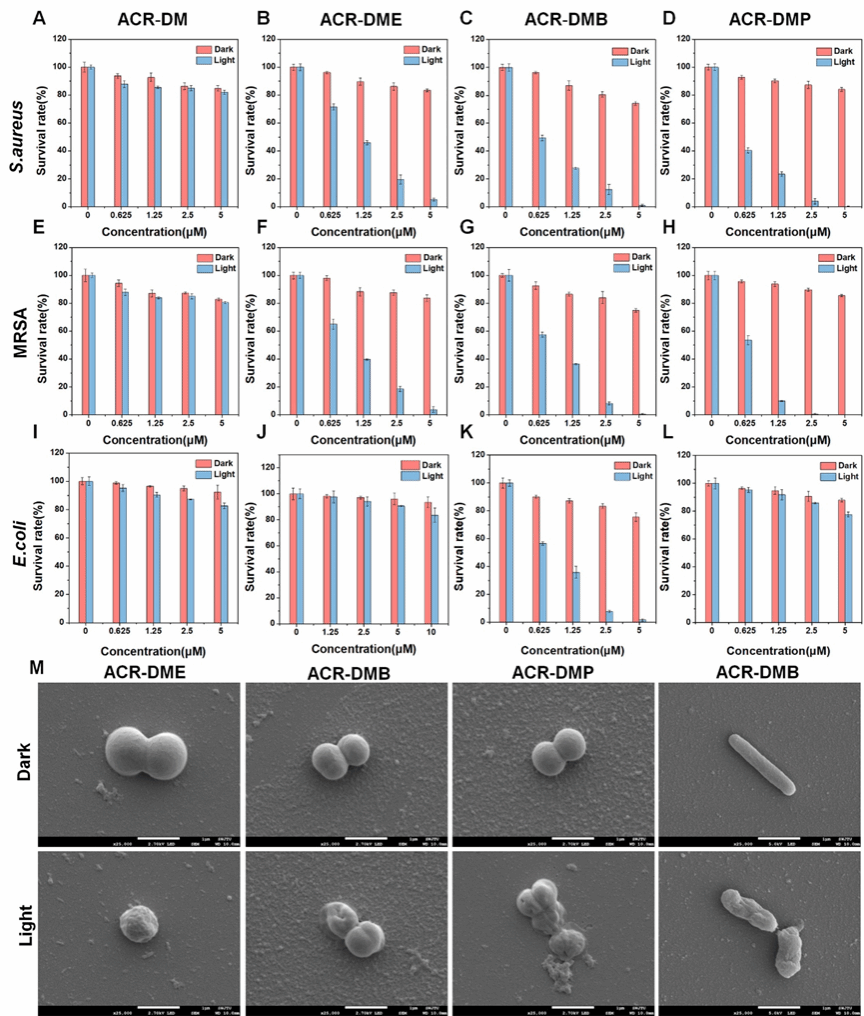
图3. 光敏剂体外抗浮游菌活性
探究了其抗浮游细菌性能(图3),未阳离子功能化的光敏剂(ACR-DM)几乎不能杀死任何细菌。随着修饰正电荷数量的增加,抗菌性能明显提高,单个正电荷的ACR-DME可有效杀灭革兰氏阳性菌,两个正电荷的ACR-DMB对阳性菌和阴性菌均表现出高效的抗菌性能。而硼酸修饰的ACR-DMP具有最优异的抗阳性菌潜力。在光照下,2.5 μM ACR-DMP 消灭了近 100% 的 MRSA。
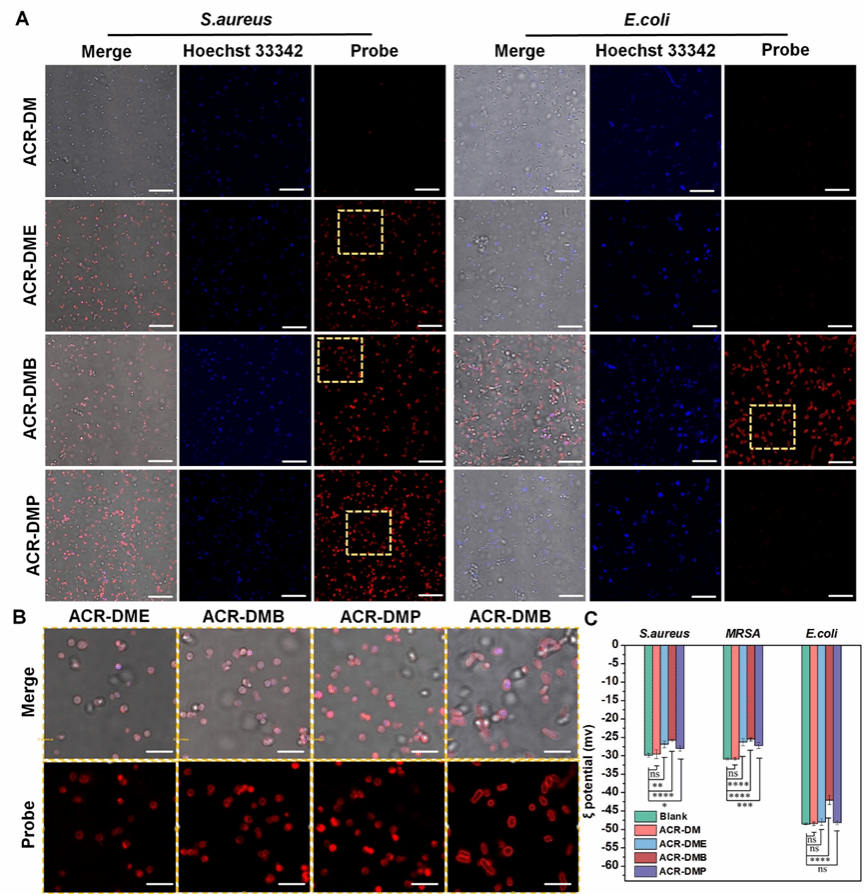
图4. (A-B)光敏剂荧光成像。(C)光敏剂对细菌电位的影响
为了考察光敏剂作用位点,对孵育后的细菌进行荧光成像。发现ACR-DMB、ACR-DME和ACR-DMP均可与细菌质膜结合,改变了细菌的膜电位。
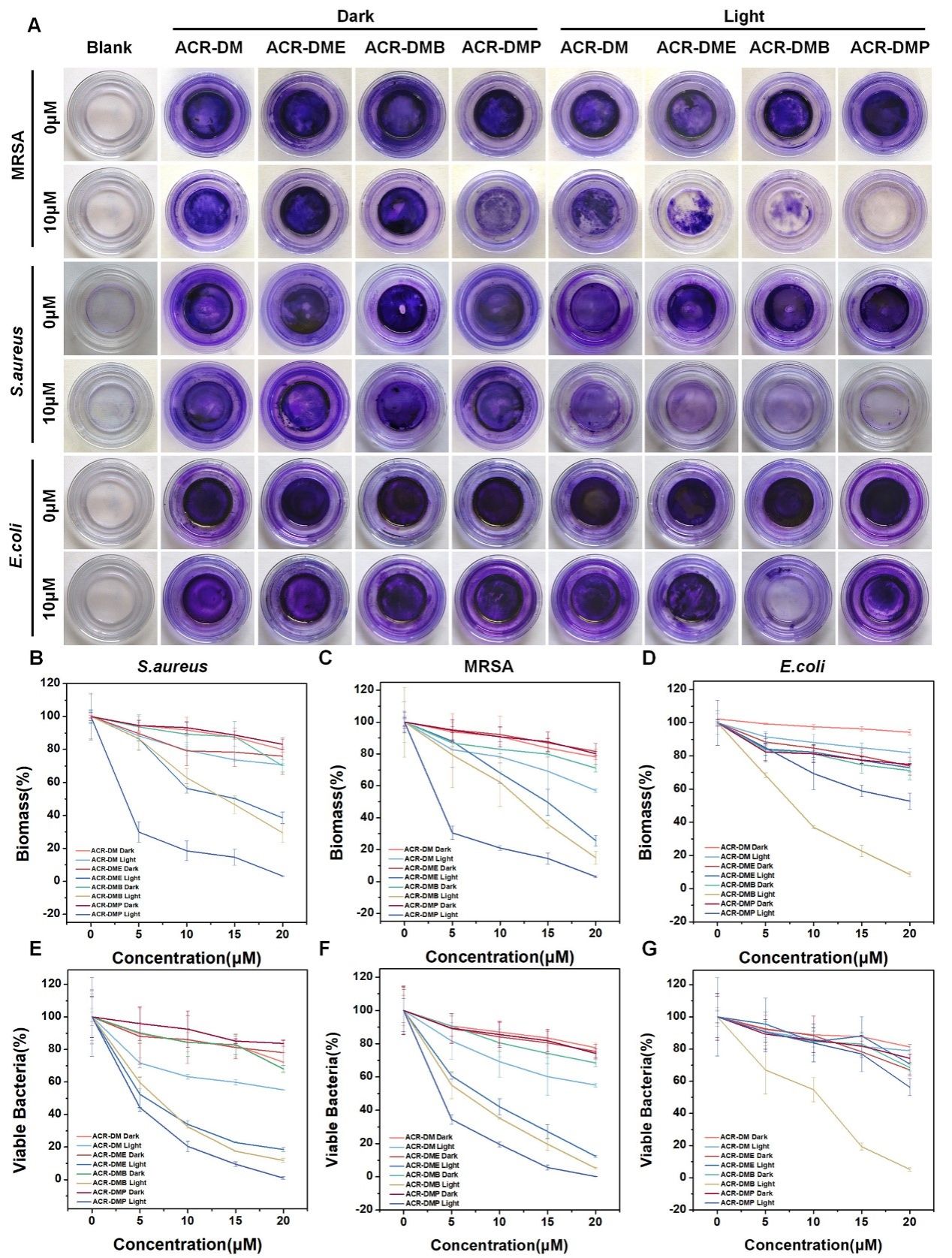
图5. 光敏剂体外抗生物膜活性
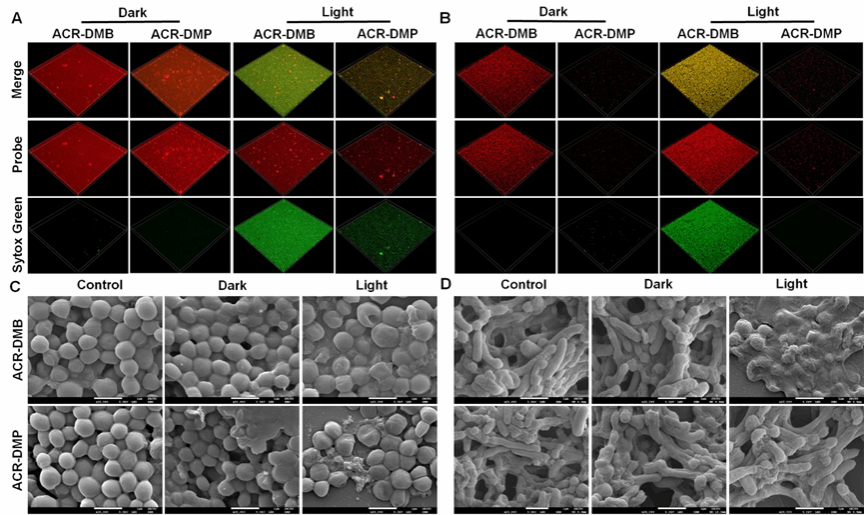
图6.光敏剂体外抗生物膜成像与形貌表征
在体外清除生物膜实验中(图5),阳离子PS均能有效地清MRSA生物膜, ACR-DMP对MRSA生物膜的清除效果最为好,10 μM ACR-DMP完全根除所有生物膜,无任何残留蓝色。通过荧光成像与电镜形貌表征(图6)也可以看出ACR-DMP不仅表现出优异的EPS渗透能力,而且与EPS内的多糖紧密结合,从而破坏细菌之间的连接并破坏生物膜结构。
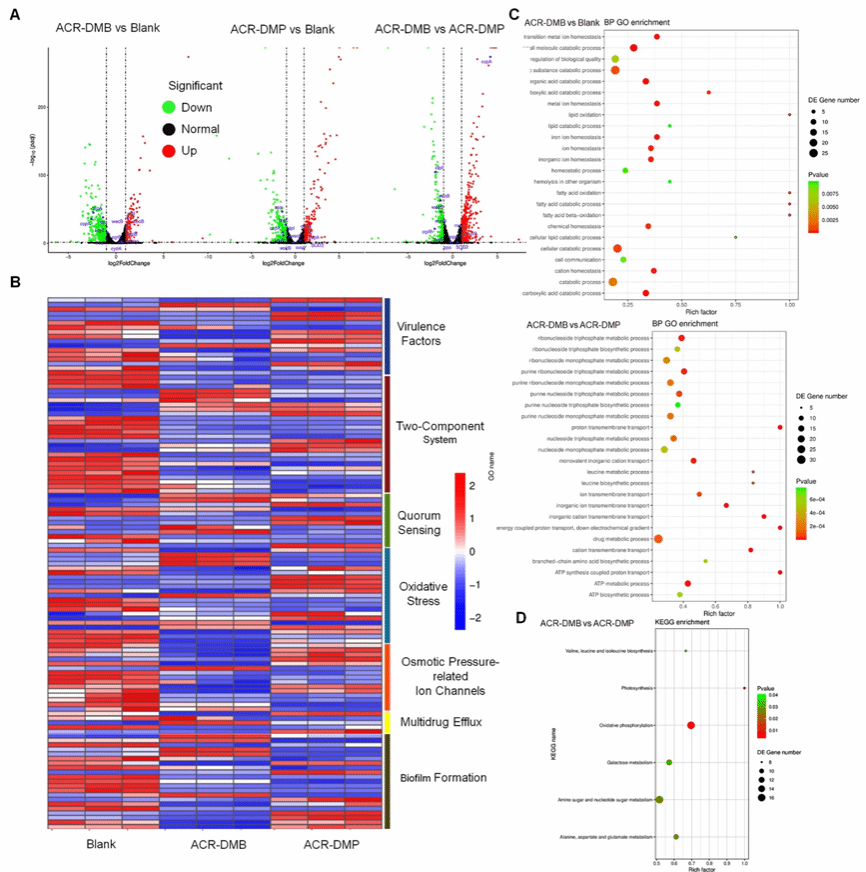
图7. 转录组学分析抗菌机理
转录组学分析显示(图7),ACR-DMB和ACR-DMP均上调氧化应激相关基因,从而破坏蛋白质合成,同时下调DNA复制、辅因子合成、毒力因子和TCS相关基因。此外,阳离子特性增强了PS的EPS的可穿透性,ACR-DMB和ACR-DMP均上调了渗透压依赖性离子通道的基因,并下调了生物膜形成基因。由于额外的正电荷,ACR-DMB表现出与细胞壁和质膜的更强结合,导致渗透压依赖性离子通道相关的更多基因变化。硼酸修饰为ACR-DMP提供了独特的特性,使其能够下调与QS和多药外排相关的基因,使ACR-DMP能够有效地对抗顽固的生物膜和细菌多药耐药性。
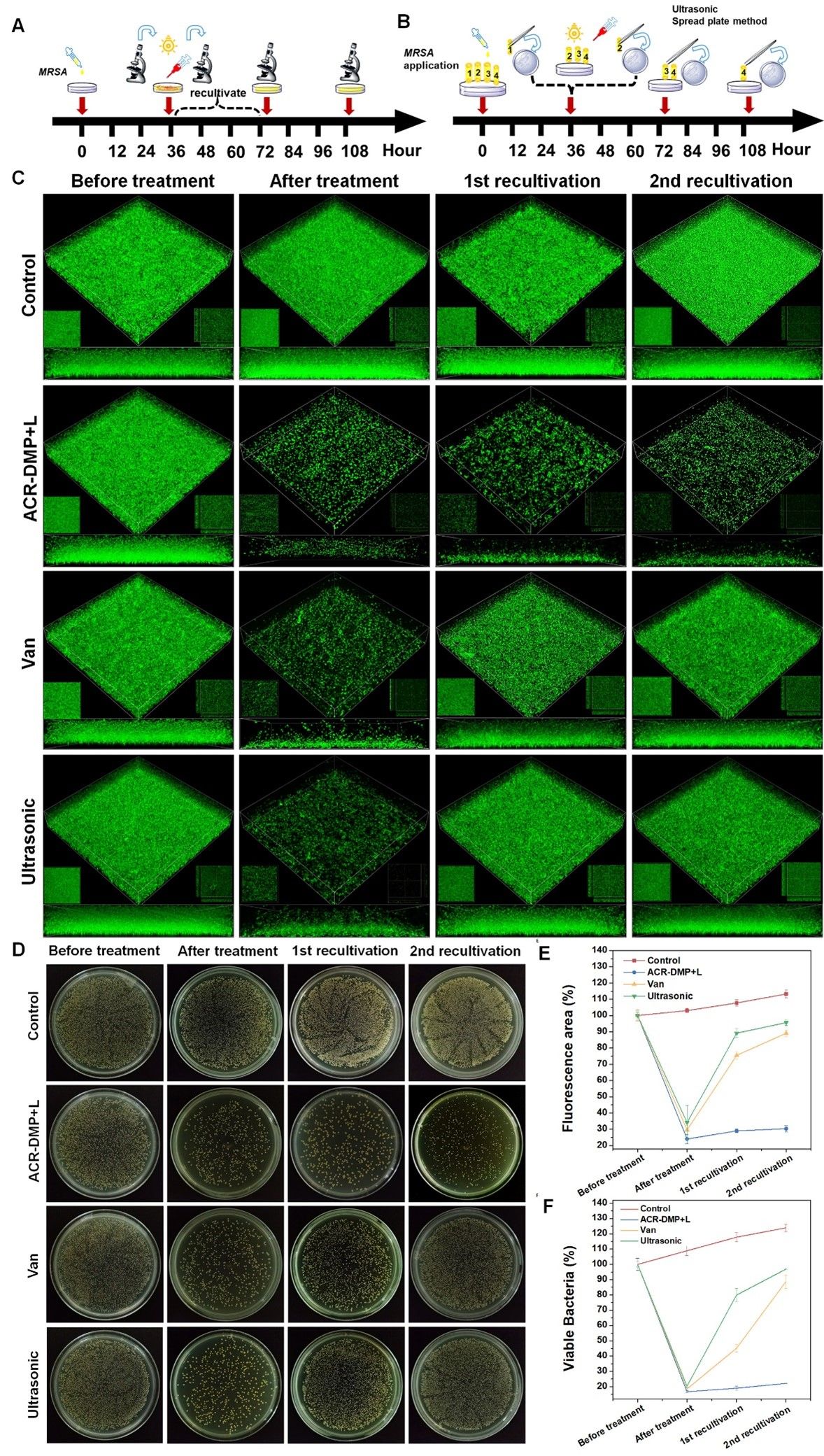
图8. ACR-DMP抑制生物膜复发实验
为了验证ACR-DMP具有抑制生物膜复发感染的能力,对万古霉素(Van)、物理刺激(超声处理)和PS处理后的生物膜进行两次再培养,发现ACR-DMP处理后明显降低了细菌重构生物膜的能力,从而证实通过靶向多糖抑制TSC,QS和外排泵的策略能有效抑制生物膜复发。当存在残留的生物膜或细菌时,ACR-DMP表现出显着的抑制生物膜复发的能力,突显了其在治疗慢性疾病和征服生物膜耐药性方面的潜在优势。
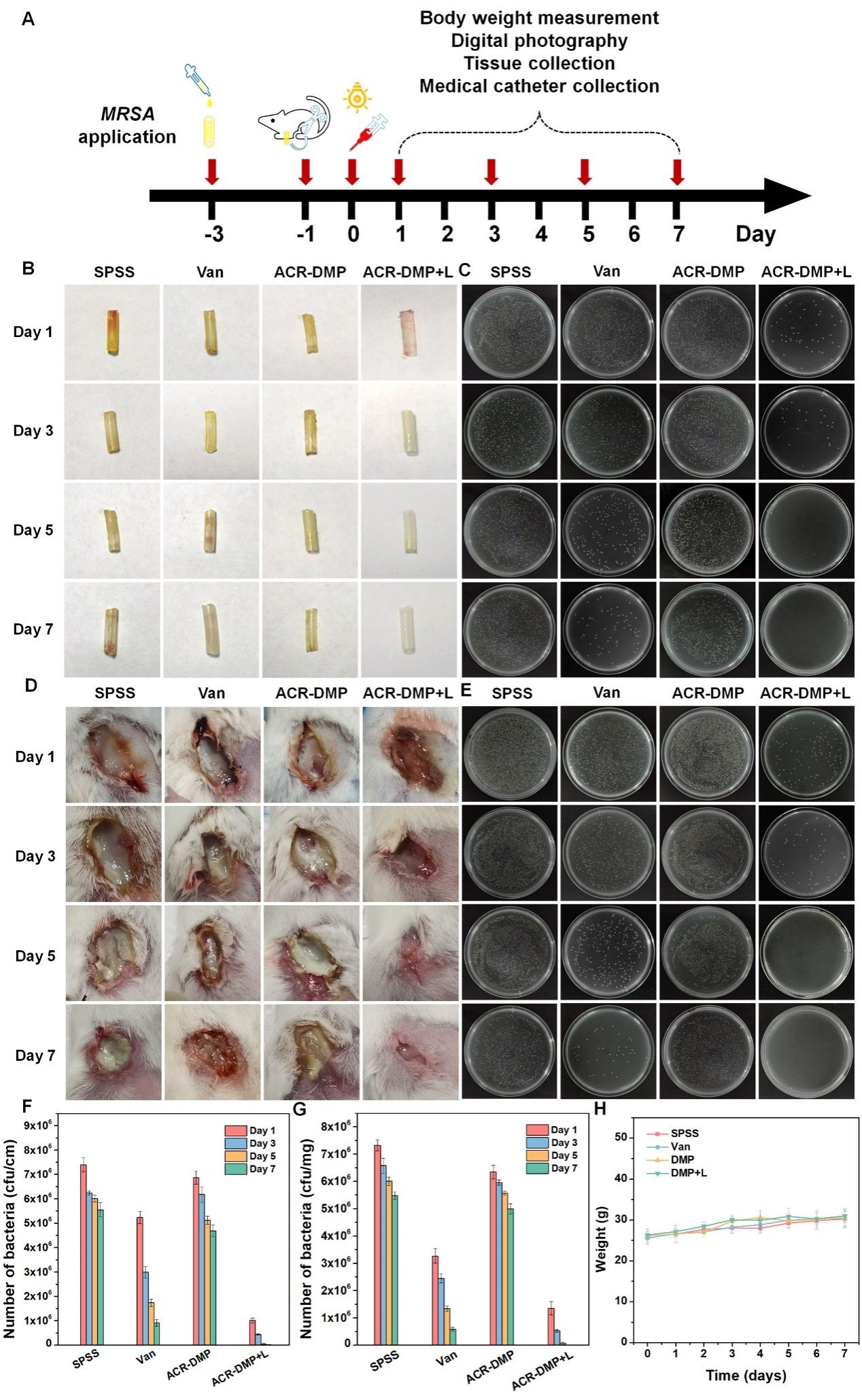
图9.ACR-DMP消除体内生物膜实验
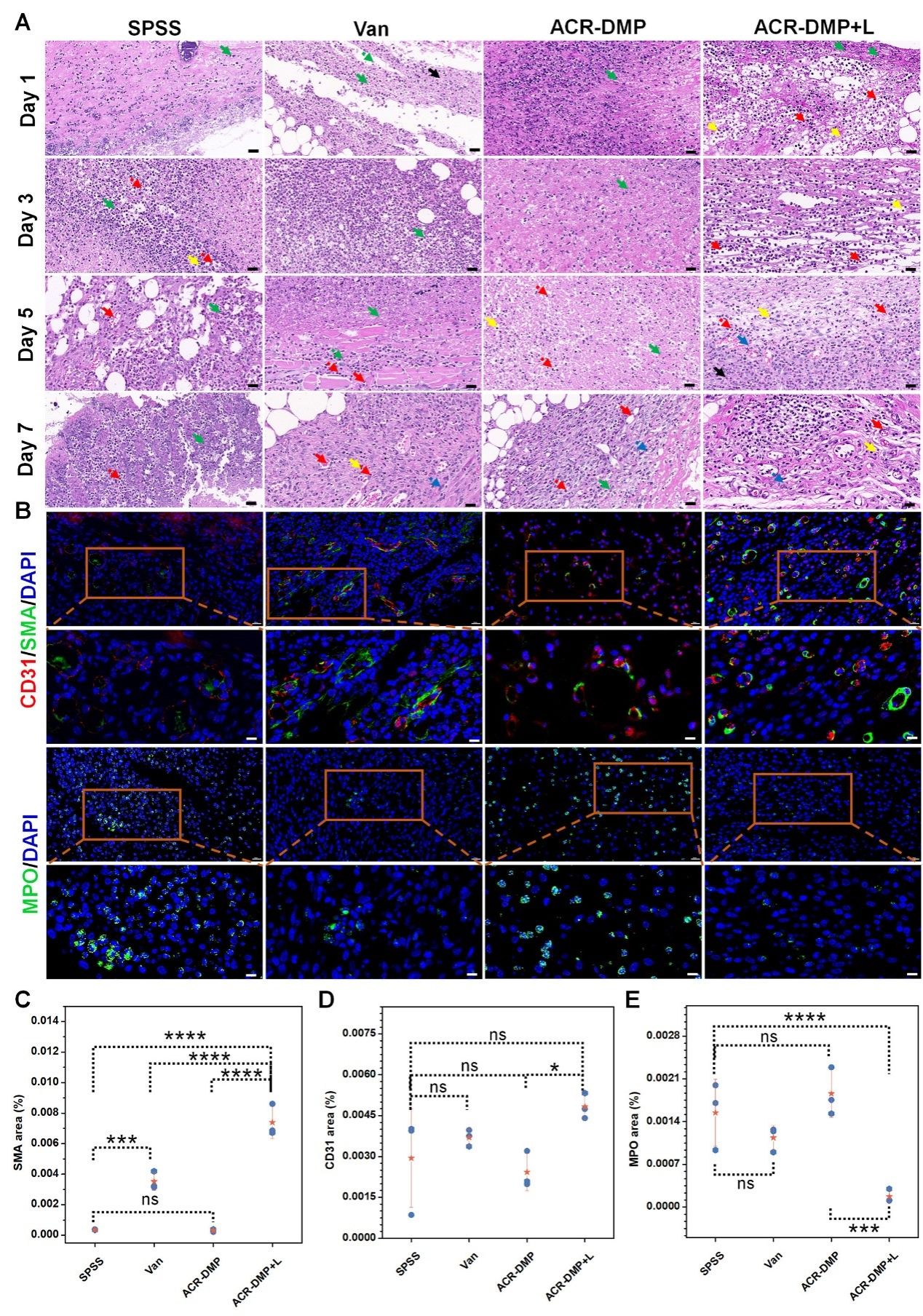
图 10.组织病理变化评估
在体内清除植入物生物膜实验中,ACR-DMP相比于万古霉素效果更加显著。ACR-DMP介导的PDT(ACR-DMP +L)在第1天杀死了大部分生物膜中的MRSA,到第 5 天细菌完全被消除,伤口的炎症反应与平板时间也证实了其清除生物膜的优异效果。此外,苏木精-伊红(H&E)染色(图10)和免疫荧光染色评估伤口组织病理变化,证明了ACR-DMP介导的PDT在对抗MRSA生物膜感染方面具有缓解炎症、增强血管形成和加速伤口愈合的能力。
总结:该团队设计并合成了一系列具有不同数量的阳离子和多糖靶向硼酸基团的I型光敏剂,系统地对PS的结构对其杀菌和清除生物膜的构效关系进行了研究。多糖靶向硼酸修饰的亲脂性阳离子光敏剂—ACR-DMP不仅能在体内外高效清除生物膜,还改变了膜电位稳态和渗透压平衡,并通过其对糖脂的靶向作用抑制了QS和TCS,降低了毒力因子的表达、下调了药物外排泵的活性,有助于克服生物膜的复发和耐药性。这项研究为临床持续性和复发性生物膜感染提供了多糖靶向阳离子抗菌材料的设计策略,为应对生物膜耐药性的抗菌材料提供了设计灵感和潜在的解决方。
本篇工作通讯作者为西南交通大学的吴明雨副教授。西南交通大学硕士生夏锋微为该论文的第一作者,上述研究工作得到了国家自然科学基金(批准号22177094和22174117)和中央大学基本科研业务费专项资金(2682023ZTPY068)的资助。
西南交通大学生命分析技术与材料实验室:

太阳成集团tyc151cc封顺教授和吴明雨副教授领导的 “生命分析技术与材料”科研团队近年来始终专注于生命健康领域的前沿基础理论研究和面向国家重大需求的应用研究,关注环境及食品安全和重大疾病的诊断与治疗。致力于开发光(荧光)、电(电化学)、色(色谱)响应/分离/富集的新材料和新方法,并将其应用于环境的检测、生命分析、药物/基因递送。承担国家自然科学基金重大项目、面上项目、青年项目和省部级基金等项目20余项,研究成果已发表在PNAS, Angew, Adv. Mater., Adv. Funct. Mater., Adv. Sci., Sci. China. Chem., Anal. Chem. 等国际顶级期刊。
吴明雨副教授介绍:

吴明雨,博士,副教授,博士生导师。2015年毕业于四川大学化学学院,获有机化学博士学位。同年进入太阳成集团tyc151cc,入选西南交通大学“雏鹰计划”;2018.6-2021.7在瑞典卡洛琳医学院从事博士后研究。主要研究方向为功能荧光染料的开发及其在荧光成像和光学诊疗中的应用。以第一/通讯作者在PNAS, Adv. Mater., Adv. Funct. Mater., Angew. Chem. Int. Ed., Sci. China. Chem., 等国内外相关领域代表性期刊发表科研论文50余篇,多篇被选为封面或封底文章。主持国家自然科学基金面上项目、自然基金青年项目和四川省科技支撑计划等多项国家和省部级项目。申请/授权中国发明专利6项。
关键词:I型光敏剂、生物膜耐药性、多糖靶向、群体感应、多药外排
